
α-手性叠氮结构单元广泛存在于药物或生物活性分子中,同时也是α-手性胺或手性含氮杂环的重要合成前体,因此高效构建α-手性叠氮具有十分重要的研究意义,但现阶段针对α-手性三级叠氮的不对称催化合成仍有待发展。通过对易得的外消旋叠氮进行动力学拆分,是获得手性叠氮的潜在高效方法之一,目前虽已报道了六例针对叔胺衍生物的动力学拆分,但尚未用于获得α-手性三级叠氮。另一方面,铜催化的叠氮与炔烃的环加成反应(CuAAC)作为点击化学的核心反应之一得到了广泛应用,但不对称催化的研究相对滞后,目前利用其来实现动力学拆分获得α-手性三级叠氮尚无报道。这可能是由于叠氮与铜的相互作用较弱,难以实现理想的对映异构体识别,因此发展高效催化体系增强叠氮与铜络合物之间的相互作用可能是实现该类反应的关键。
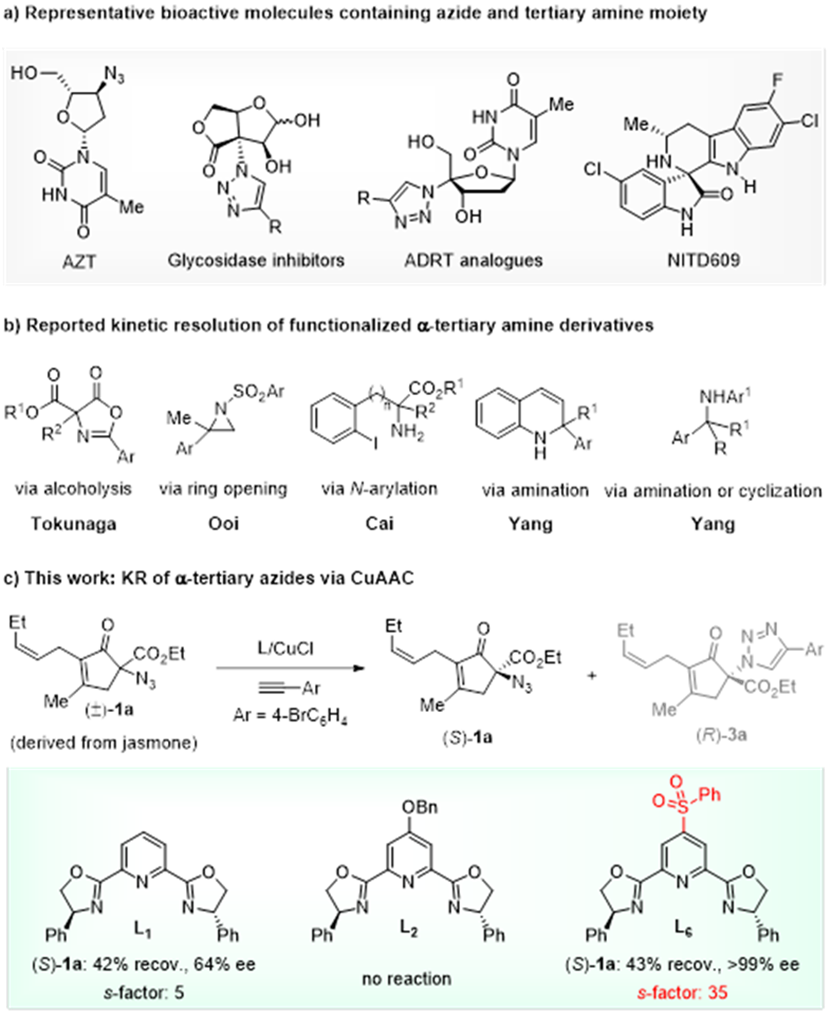
图一、手性叠氮重要性及α-叔胺衍生物的动力学拆分
最近,华东师范大学周锋和周剑教授团队基于前期在不对称催化CuAAC反应领域的研究基础(J. Am. Chem. Soc. 2013, 135, 10994; Chem. Sci. 2020, 11, 97; Org. Lett. 2020, 22, 1270;Angew. Chem. Int. Ed. 2021, 60, 8488),设计发展了一类吡啶C4位含拉电子砜基取代的新型手性Pybox配体,并成功应用于外消旋三级叠氮的动力学拆分和不对称CuAAC反应中,分别实现了a-手性三级叠氮和手性三氮唑的高立体选择性合成。通过动力学拆分,能以高达47%的回收率,99%的ee值获得具有多种分子骨架的a-手性三级叠氮。基于三级叠氮与炔烃的不对称CuAAC反应,能够以高达95%产率和99%的ee值得到系列a-手性三氮唑;含雌酚酮、睾酮、吲哚美辛、芬布芬、氮杂青蒿素结构片段的炔烃均能很好地适用于该反应。
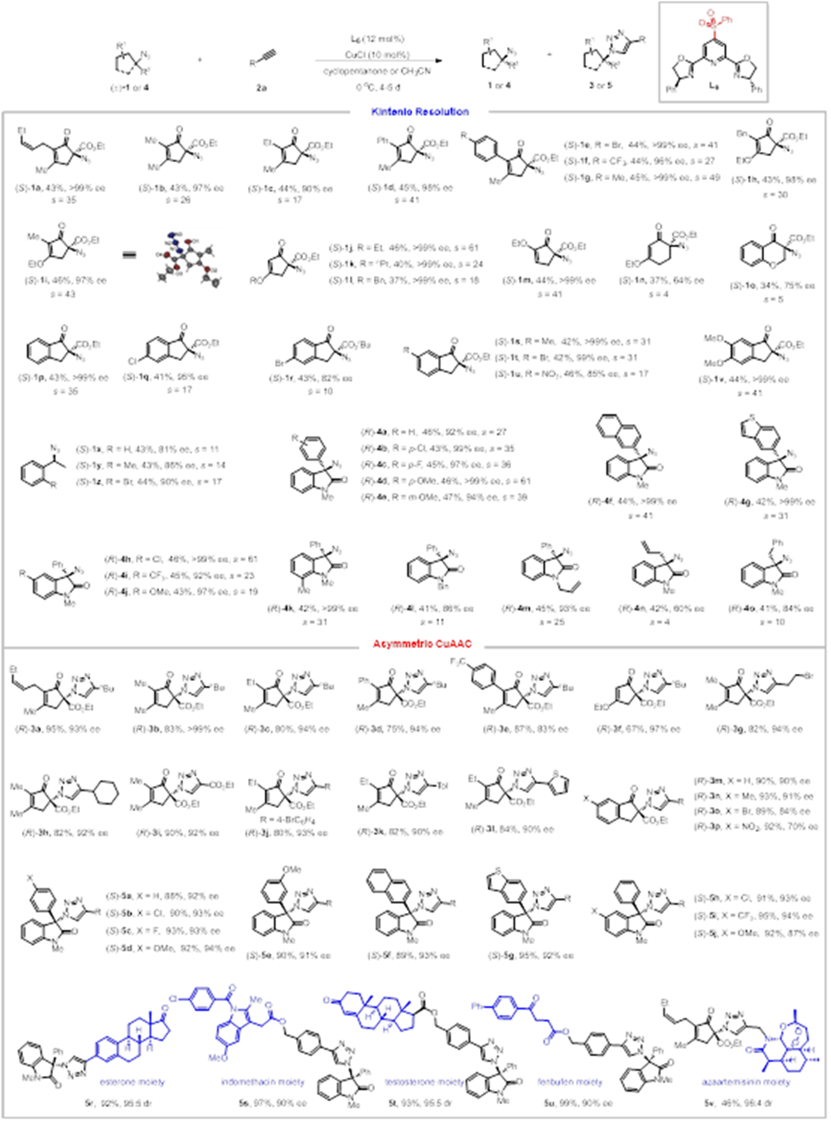
图二、三级叠氮的动力学拆分和不对称CuAAC反应
所得手性三级叠氮可进一步转化为手性氨基酸、氨基醇、叔胺、异氰酸酯、磷酰胺、硫脲及手性杂环等,还可用于生物活性分子Kjellmanianone氮杂类似物的合成。
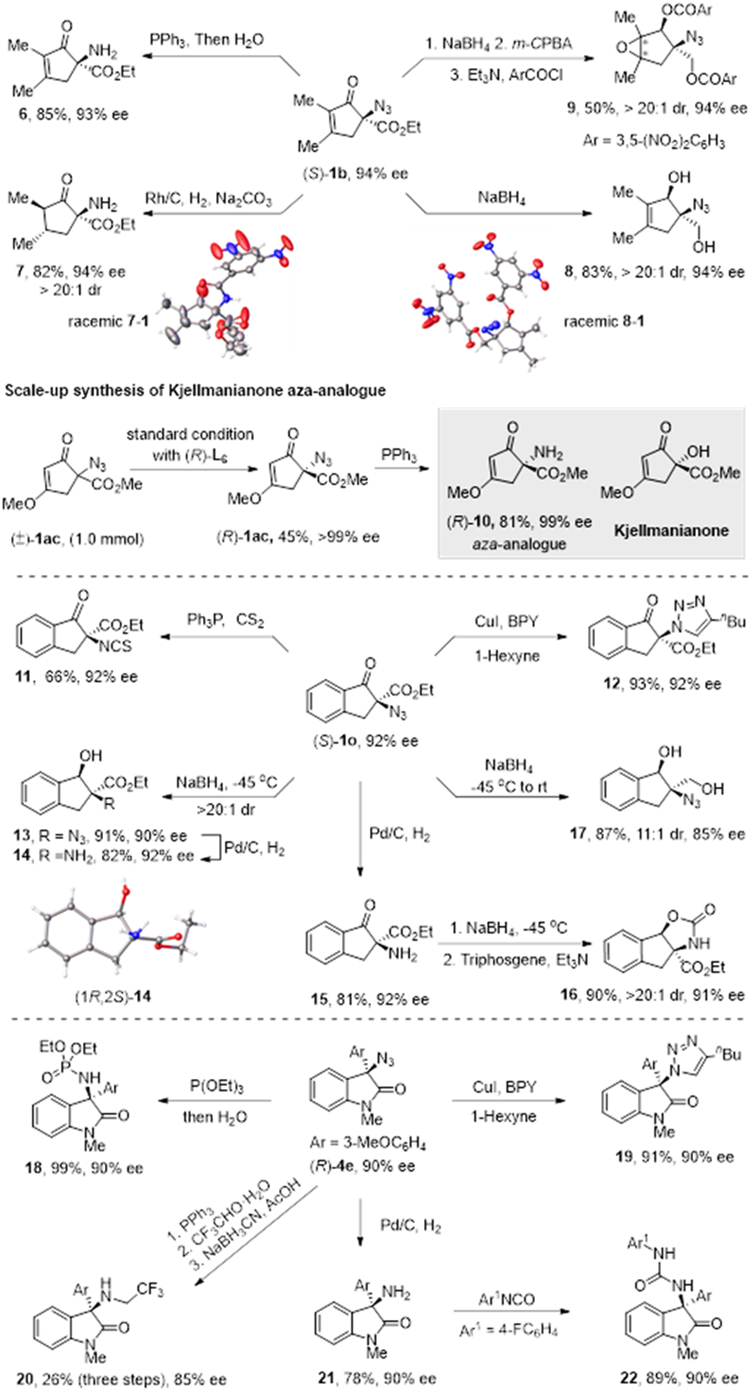
图三、a-手性三级叠氮的合成应用
实验结果显示Pybox配体吡啶C4取代基对反应活性和对映选择性有显著影响,为了探究其中的作用机制,作者与四川大学王欣教授合作进行了理论计算研究。结果表明,一方面砜基的吸电子效应可以减弱吡啶的Lewis碱性,进而增强中心金属铜的Lewis酸性,最终使得手性铜络合物可以更好地与外消旋叠氮作用;另一方面,大位阻砜基的引入可以形成更为拥挤的手性口袋,从而能更好地区分两种对映异构体。最终在电子效应和位阻效应的共同作用下,两种构型产物的反应过渡态能垒由1.9 kcal/mol增加为4.9 kcal/mol,相应地反应的对映选择性大幅度提高,与实验结果相吻合。

图四、优化的反应过渡态结构和相对吉布斯自由能
在该工作中,周锋和周剑教授团队利用所发展的吡啶C4位砜基取代的Pybox配体,实现了a-三级叠氮的高对映选择性CuAAC反应及其动力学拆分,理论计算研究阐明了配体中吡啶C4位取代基对反应活性和对映选择性的影响机制,对后续新型手性配体的设计合成和新型不对称催化反应的发展有重要借鉴意义。
论文信息
Sulfonyl-PYBOX Ligands Enable Kinetic Resolution of α-Tertiary Azides by CuAAC
Yi Gong, Cai Wang, Prof. Dr. Feng Zhou, Kui Liao, Xi-Yu Wang, Ying Sun, Yan-Xue Zhang, Zhi Tu, Prof. Dr. Xin Wang, Prof. Dr. Jian Zhou
Angewandte Chemie International Edition
DOI: 10.1002/anie.202301470